Autor:
Monica Porter
Erstelldatum:
22 Marsch 2021
Aktualisierungsdatum:
1 Juli 2024
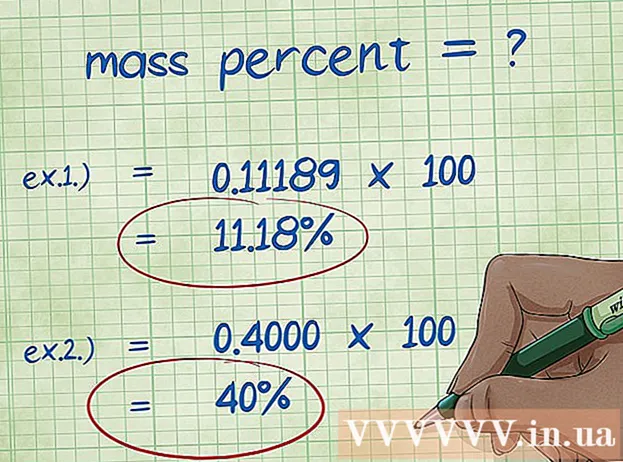
Inhalt
Massenprozent gibt den Prozentsatz jedes Elements in einer chemischen Verbindung an. Um den Massenprozentsatz zu ermitteln, muss man die Molmasse der Elemente in der Verbindung in Gramm / Mol oder die Anzahl der Gramm der Substanzen kennen, aus denen die Lösung besteht. Der Massenprozentsatz wird unter Verwendung einer einfachen Formel berechnet, die die Masse des Elements (oder gelösten Stoffes) durch die Masse der Verbindung (oder Lösung) dividiert.
Schritte
Methode 1 von 2: Berechnen Sie den Massenprozentsatz in Kenntnis der Masse
Bestimmen Sie die Gleichung für den Prozentsatz der Masse in der Mischung. Die Grundformel zur Berechnung des Massenprozentsatzes in der Mischung lautet: Massenprozentsatz = (Qualitätsmasse / Mischmasse) x 100. Schließlich müssen Sie mit 100 multiplizieren, um den Prozentsatz darzustellen.
- Schreiben Sie eine Gleichung, wenn Sie das Problem lösen: Massenprozentsatz = (Stoffmasse / Mischmasse) x 100.
- Die Menge an Qualität wird im Problem angegeben. Wenn das Thema keine Informationen enthält, lesen Sie im folgenden Abschnitt nach, wie Sie Massenprozentsätze ermitteln, ohne die Gewichte zu kennen.
- Die Masse des Gemisches entspricht der Gesamtmasse der Substanzen, aus denen das Gemisch oder die Lösung besteht.

Berechnen Sie die Masse der Mischung. Sobald Sie die Massen der Elemente oder Verbindungen kennen, müssen Sie sie nur noch addieren, um die Masse der endgültigen Mischung oder Lösung zu erhalten. Dies ist der Nenner in der Prozent-Massenformel.- Beispiel 1: Was ist der Massenprozentsatz von 5 g Natriumhydroxid, wenn es mit 100 g Wasser gelöst wird?
- Die Masse der Mischung ist die Gesamtmasse von Natriumhydroxid und Wasser: 100 g + 5 g. Die Mischmasse beträgt also 105g.
- Beispiel 2: Welche Masse Natriumchlorid und Wasser wird benötigt, um 175 g eine 15% ige Lösung zu bilden?
- In diesem Beispiel, in dem Sie die gemischte Masse und den Massenprozentsatz kennen, werden Sie aufgefordert, die Masse des zugesetzten gelösten Stoffs zu ermitteln. Die Masse der Mischung beträgt 175 g.
- Beispiel 1: Was ist der Massenprozentsatz von 5 g Natriumhydroxid, wenn es mit 100 g Wasser gelöst wird?

Bestimmen Sie die Masse der Substanz, um die prozentuale Masse zu ermitteln. Wenn Sie im Quiz nach dem "Massenprozentsatz" einer Substanz gefragt werden, müssen Sie die Masse der Substanz als Prozentsatz der Gesamtmasse aller Inhaltsstoffe ermitteln. Notieren Sie die Masse der Substanz, um die prozentuale Masse zu ermitteln. Dies ist der Zähler in der Formel für die prozentuale Masse.- Beispiel 1: Die Masse an Natriumhydroxid (Substanz nach Massenfraktion) beträgt 5 g.
- Beispiel 2: In diesem Beispiel sucht die Menge der Substanz nach dem Prozentsatz der unbekannten Masse, und Sie suchen danach.

Ersetzen Sie die Variablen durch die Massenprozentsatzgleichung. Wenn Sie den Wert jeder Variablen ermittelt haben, fügen Sie sie einfach in die Gleichung ein.- Beispiel 1: Massenprozentsatz = (Substanzmasse / Mischmasse) x 100 = (5 g / 105 g) x 100.
- Beispiel 2: Wir müssen die Massenprozentsatzgleichung konvertieren, um die Menge unbekannter Qualität zu berechnen: Qualitätsmasse = (Prozentmasse * Mischmasse) / 100 = (15 * 175) / 100 .
Berechnen Sie den Volumenprozentsatz. Nachdem die Gleichung ausgefüllt ist, müssen Sie nur noch den Massenprozentsatz berechnen. Teilen Sie die Masse der Substanz durch die Masse der Mischung und multiplizieren Sie sie dann mit 100. Dies ist der Massenprozentsatz der Substanz in der Mischung.
- Beispiel 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Daher beträgt der Massenprozentsatz von 5 g Natriumhydroxid, gelöst in 100 g Wasser, 4.761%.
- Beispiel 2: Die Gleichung nach der Umrechnung zur Berechnung der Qualitätsmenge lautet (prozentuale Masse * Mischgewicht) / 100: (15 * 175) / 100 = (2625) / 100 = 26,25 Gramm Natriumchlorid.
- Das Gewicht des zugesetzten Wassers ist die Masse der Mischung abzüglich der Masse der Qualität: 175 - 26,25 = 148,75 Gramm Wasser.
Methode 2 von 2: Berechnen Sie den Massenprozentsatz, wenn die Masse unbekannt ist
Bestimmen Sie die Gleichung für den Prozentsatz der Masse in der Verbindung. Die Grundformel zur Berechnung des Massenprozentsatzes in einer Verbindung lautet: Massenprozentsatz = (Molmasse der Elemente / Molmasse der Verbindung) x 100. Die Molmasse des Elements ist die Masse eines Mols Element während die Molekularmasse die Masse eines Mols der Verbindung ist. Schließlich müssen Sie mit 100 multiplizieren, um den Prozentwert zu erhalten.
- Schreiben Sie eine Gleichung, wenn Sie das Problem lösen: Massenprozentsatz = (elementare Molmasse / Molmasse der Verbindung) x 100.
- Die Einheiten der obigen zwei Werte sind Gramm pro Mol (g / mol).
- Wenn das Problem keine Masse ergibt, können Sie die Molmasse verwenden, um den Massenprozentsatz des Elements zu berechnen.
- Beispiel 1: Berechnen Sie den Massenprozentsatz von Wasserstoff in einem Wassermolekül.
- Beispiel 2: Berechnen Sie den Massenprozentsatz von Kohlenstoff in einem Glucosemolekül.
Schreiben Chemische Formel. Wenn das Problem nicht die chemischen Formeln für jede Verbindung abdeckt, müssen Sie sie aufschreiben. Wenn das Problem bei der chemischen Formel liegt, überspringen Sie diesen Schritt und fahren Sie mit dem Schritt "Masse jedes Elements ermitteln" fort.
- Beispiel 1: Schreiben Sie die chemische Formel für Wasser, H.2Ö.
- Beispiel 2: Schreiben Sie die chemische Formel für Glucose, C.6H.12Ö6.
Finden Sie die Masse jedes Elements in der Verbindung. Schlagen Sie das Molekulargewicht jedes Elements in der chemischen Formel im Periodensystem nach. Die Elementmasse wird normalerweise unter das chemische Symbol geschrieben. Notieren Sie die Masse jedes Elements in der Verbindung.
- Beispiel 1: Wir können feststellen, dass das Massenatom von Sauerstoff 15.9994 beträgt; und das kubische Atom Wasserstoff ist 1.0079.
- Beispiel 2: Wir fanden, dass das Massenatom von Kohlenstoff 12.0107 beträgt; Sauerstoff ist 15.9994; und der Wasserstoff ist 1,0079.
Multiplizieren Sie das kubische Atom mit dem Molverhältnis. Bestimmen Sie die Molzahl (Molverhältnis) jedes Elements in der chemischen Verbindung. Das Molverhältnis wird durch die kleine Zahl unten in der chemischen Formel der Verbindung berechnet. Multiplizieren Sie das kubische Atom jedes Elements mit dem Molverhältnis.
- Beispiel 1: Wasserstoff hat einen Index von zwei, während Sauerstoff einen Index von 1 hat. Multiplizieren Sie also das Molekulargewicht von Wasserstoff mit 2, 1.00794 x 2 = 2.01588; und die molekulare Masse von Sauerstoff beträgt 15.9994 (multipliziert mit eins).
- Beispiel 2: Kohlenstoff hat einen Index von 6, Wasserstoff ist 12 und Sauerstoff ist 6. Multiplizieren Sie das kubische Atom jedes Elements mit dem folgenden Index.
- Kohlenstoff (12.0107 * 6) = 72.0642
- Wasserstoff (1.00794 * 12) = 12.09528
- Sauerstoff (15.9994 * 6) = 95.9964
Berechnen Sie die Gesamtmasse der Verbindung. Addieren Sie die Massen aller Elemente in der Verbindung. Sie können die Gesamtmasse der Verbindungen anhand der in Molverhältnissen ausgedrückten Massen berechnen. Diese Zahl ist der Nenner in der Prozentmassengleichung.
- Beispiel 1: Zugabe von 2.01588 g / mol (die Masse von zwei Mol Wasserstoffatomen) zu 15.9994 g / mol (die Masse von einem Mol Sauerstoffatomen) ergibt 18.01528 g / mol.
- Beispiel 2: Addiere alle Gewichte zusammen: Kohlenstoff + Wasserstoff + Sauerstoff = 72.0642 + 12.09528 + 95.9964 = 180.156 g / mol.
Bestimmen Sie die Elementmasse, auf die der Massenprozentsatz berechnet werden soll. Wenn das Problem nach "Massenprozentsatz" fragt, bedeutet dies, dass Sie die Masse eines bestimmten Elements in der Verbindung als Prozentsatz der Gesamtmasse aller Elemente ermitteln müssen. Bestimmen und notieren Sie die Masse des Elements. Diese Masse ist die im Molverhältnis ausgedrückte Masse. Diese Zahl ist der Zähler der Prozentmassengleichung.
- Beispiel 1: Die Masse an Wasserstoff in einer Verbindung beträgt 2.01588 g / mol (die Masse von zwei Mol Wasserstoffatomen).
- Beispiel 2: Die Kohlenstoffmasse in einer Verbindung beträgt 72.0642 g / mol (die Masse von sechs Mol Kohlenstoffatomen).
Setzen Sie die Variablen in die Massenprozentsatzgleichung ein. Nachdem Sie die Werte jeder Variablen ermittelt haben, ersetzen Sie sie einfach durch die im ersten Schritt angegebene Gleichung: Massenprozentsatz = (Molmasse der Elemente / Molmasse der Verbindung) x 100 .
- Beispiel 1: Massenprozentsatz = (Molmasse der Elementarmasse / Molmasse der Verbindung) x 100 = (2.1588 / 18.1528) x 100.
- Beispiel 2: Massenprozentsatz = (Molmasse der Elemente / Molmasse der Verbindung) x 100 = (72.0642 / 180.156) x 100.
Berechnen Sie den Volumenprozentsatz. Nachdem die Gleichung ausgefüllt ist, müssen Sie nur noch den Massenprozentsatz berechnen. Teilen Sie die Masse des Elements durch die Gesamtmasse der Verbindung und multiplizieren Sie sie dann mit 100. Dies ist der Prozentsatz der Masse des Elements in der Verbindung.
- Beispiel 1: Massenprozent = (2,01588 / 18,01528) × 100 = 0,111189 × 100 = 11,18%. Daher beträgt der Massenprozentsatz des Wasserstoffatoms im Wassermolekül 11,18%.
- Beispiel 2: Massenprozentsatz = (Elementmolmasse / Molmasse der Verbindung) x 100 = (72.0642 / 180.156) x 100 = 0,4000 x 100 = 40,00%. Der Massenprozentsatz des Kohlenstoffatoms im Glucosemolekül beträgt also 40,00%.