Autor:
Virginia Floyd
Erstelldatum:
6 August 2021
Aktualisierungsdatum:
1 Juli 2024
Inhalt
- Schritte
- Methode 1 von 3: Die Grundlagen
- Methode 2 von 3: Bestimmung der Bindungsart durch Elektronegativität
- Methode 3 von 3: Berechnung der Mulliken-Elektronegativität
- Tipps
In der Chemie ist Elektronegativität die Fähigkeit von Atomen, Elektronen von anderen Atomen anzuziehen. Ein Atom mit hoher Elektronegativität zieht Elektronen stark an und ein Atom mit niedriger Elektronegativität zieht Elektronen schwach an. Elektronegativitätswerte werden verwendet, um das Verhalten verschiedener Atome in chemischen Verbindungen vorherzusagen.
Schritte
Methode 1 von 3: Die Grundlagen
 1 Chemische Bindungen. Solche Bindungen entstehen, wenn Elektronen in Atomen miteinander wechselwirken, das heißt, zwei Elektronen (eines von jedem Atom) werden gemeinsam.
1 Chemische Bindungen. Solche Bindungen entstehen, wenn Elektronen in Atomen miteinander wechselwirken, das heißt, zwei Elektronen (eines von jedem Atom) werden gemeinsam. - Eine Beschreibung der Gründe für die Wechselwirkung von Elektronen in Atomen würde den Rahmen dieses Artikels sprengen.Weitere Informationen zu diesem Thema finden Sie beispielsweise in diesem Artikel.
 2 Wirkung der Elektronegativität. Wenn zwei Atome die Elektronen des anderen anziehen, ist die Anziehungskraft nicht gleich. Ein Atom mit höherer Elektronegativität zieht zwei Elektronen stärker an. Ein Atom mit sehr hoher Elektronegativität zieht Elektronen mit einer solchen Kraft an, dass wir nicht mehr von geteilten Elektronen sprechen.
2 Wirkung der Elektronegativität. Wenn zwei Atome die Elektronen des anderen anziehen, ist die Anziehungskraft nicht gleich. Ein Atom mit höherer Elektronegativität zieht zwei Elektronen stärker an. Ein Atom mit sehr hoher Elektronegativität zieht Elektronen mit einer solchen Kraft an, dass wir nicht mehr von geteilten Elektronen sprechen. - Im NaCl-Molekül (Natriumchlorid, Kochsalz) beispielsweise hat das Chloratom eine ziemlich hohe Elektronegativität und das Natriumatom ist eher niedrig. Also Elektronen werden vom Chloratom angezogen und Natriumatome abstoßen.
 3 Elektronegativitätstabelle. Diese Tabelle enthält chemische Elemente, die wie im Periodensystem angeordnet sind, aber für jedes Element ist die Elektronegativität seiner Atome angegeben. Eine solche Tabelle kann in Chemielehrbüchern, Nachschlagewerken und im Internet gefunden werden.
3 Elektronegativitätstabelle. Diese Tabelle enthält chemische Elemente, die wie im Periodensystem angeordnet sind, aber für jedes Element ist die Elektronegativität seiner Atome angegeben. Eine solche Tabelle kann in Chemielehrbüchern, Nachschlagewerken und im Internet gefunden werden. - Eine ausgezeichnete Elektronegativitätstabelle finden Sie hier. Beachten Sie, dass die Elektronegativitätsskala nach Pauling verwendet wird, die am häufigsten verwendet wird. Es gibt jedoch andere Möglichkeiten, die Elektronegativität zu berechnen, von denen eine unten diskutiert wird.
 4 Elektronegativitätstrends. Wenn Sie keine Elektronegativitätstabelle zur Hand haben, können Sie die Elektronegativität eines Atoms anhand der Position eines Elements im Periodensystem abschätzen.
4 Elektronegativitätstrends. Wenn Sie keine Elektronegativitätstabelle zur Hand haben, können Sie die Elektronegativität eines Atoms anhand der Position eines Elements im Periodensystem abschätzen. - Wie Nach rechts das Element liegt, das mehr die Elektronegativität seines Atoms.
- Wie höher das Element liegt, das mehr die Elektronegativität seines Atoms.
- Somit haben die Atome der Elemente in der oberen rechten Ecke des Periodensystems die höchsten Elektronegativitäten und die Atome der Elemente in der unteren linken Ecke haben die niedrigsten.
- In unserem NaCl-Beispiel können wir sagen, dass Chlor eine höhere Elektronegativität hat als Natrium, da Chlor rechts von Natrium liegt.
Methode 2 von 3: Bestimmung der Bindungsart durch Elektronegativität
 1 Berechnen Sie den Unterschied zwischen den Elektronegativitäten zweier Atome, um die Eigenschaften der Bindung zwischen ihnen zu verstehen. Ziehen Sie dazu die kleinere Elektronegativität von der größeren ab.
1 Berechnen Sie den Unterschied zwischen den Elektronegativitäten zweier Atome, um die Eigenschaften der Bindung zwischen ihnen zu verstehen. Ziehen Sie dazu die kleinere Elektronegativität von der größeren ab. - Betrachten Sie zum Beispiel das HF-Molekül. Subtrahiere die Elektronegativität von Wasserstoff (2.1) von der Elektronegativität von Fluor (4.0): 4.0 - 2.1 = 1,9.
 2 Beträgt die Differenz weniger als 0,5, so ist die Bindung kovalent unpolar, bei der Elektronen mit nahezu gleicher Stärke angezogen werden. Solche Bindungen werden zwischen zwei identischen Atomen gebildet. Unpolare Verbindungen sind im Allgemeinen sehr schwer zu trennen. Dies liegt daran, dass Atome Elektronen teilen, was ihre Bindung stabil macht. Es braucht viel Energie, um es zu zerstören.
2 Beträgt die Differenz weniger als 0,5, so ist die Bindung kovalent unpolar, bei der Elektronen mit nahezu gleicher Stärke angezogen werden. Solche Bindungen werden zwischen zwei identischen Atomen gebildet. Unpolare Verbindungen sind im Allgemeinen sehr schwer zu trennen. Dies liegt daran, dass Atome Elektronen teilen, was ihre Bindung stabil macht. Es braucht viel Energie, um es zu zerstören. - Zum Beispiel das Molekül O2 hat diese Art der Verbindung. Da zwei Sauerstoffatome die gleiche Elektronegativität haben, beträgt die Differenz zwischen ihnen 0.
 3 Liegt die Differenz im Bereich von 0,5 - 1,6, dann ist die Bindung kovalent polar. In diesem Fall zieht eines der beiden Atome Elektronen stärker an und erhält daher eine negative Teilladung, das andere eine positive Teilladung. Dieses Ladungsungleichgewicht ermöglicht es dem Molekül, an bestimmten Reaktionen teilzunehmen.
3 Liegt die Differenz im Bereich von 0,5 - 1,6, dann ist die Bindung kovalent polar. In diesem Fall zieht eines der beiden Atome Elektronen stärker an und erhält daher eine negative Teilladung, das andere eine positive Teilladung. Dieses Ladungsungleichgewicht ermöglicht es dem Molekül, an bestimmten Reaktionen teilzunehmen. - Zum Beispiel das Molekül H2O (Wasser) hat diese Art von Bindung. Das O-Atom ist elektronegativer als zwei H-Atome, daher zieht Sauerstoff Elektronen stärker an und erhält eine negative Teilladung und Wasserstoff eine positive Teilladung.
 4 Wenn die Differenz größer als 2,0 ist, ist die Bindung ionisch. Dies ist eine Bindung, bei der das gemeinsame Elektronenpaar überwiegend zu einem Atom mit einer höheren Elektronegativität übergeht, das eine negative Ladung erhält, und ein Atom mit einer niedrigeren Elektronegativität eine positive Ladung erhält. Moleküle mit solchen Bindungen reagieren gut mit anderen Atomen und können sogar von polaren Atomen zerstört werden.
4 Wenn die Differenz größer als 2,0 ist, ist die Bindung ionisch. Dies ist eine Bindung, bei der das gemeinsame Elektronenpaar überwiegend zu einem Atom mit einer höheren Elektronegativität übergeht, das eine negative Ladung erhält, und ein Atom mit einer niedrigeren Elektronegativität eine positive Ladung erhält. Moleküle mit solchen Bindungen reagieren gut mit anderen Atomen und können sogar von polaren Atomen zerstört werden. - Zum Beispiel hat das NaCl (Natriumchlorid)-Molekül diese Art von Bindung.Das Chloratom ist so elektronegativ, dass es beide Elektronen anzieht und eine negative Ladung annimmt, und das Natriumatom erhält eine positive Ladung.
- NaCl kann durch ein polares Molekül wie H2O (Wasser) zerstört werden. Bei einem Wassermolekül ist die Wasserstoffseite des Moleküls positiv und die Sauerstoffseite negativ. Wenn Sie Salz mit Wasser mischen, zersetzen die Wassermoleküle die Salzmoleküle, wodurch sie sich auflösen.
 5 Wenn der Unterschied zwischen 1,6 und 2,0 liegt, prüfen Sie auf Metall. Wenn in einem Molekül ein Metallatom vorhanden ist, ist die Bindung ionisch. Sind im Molekül keine Metallatome vorhanden, ist die Bindung polar kovalent.
5 Wenn der Unterschied zwischen 1,6 und 2,0 liegt, prüfen Sie auf Metall. Wenn in einem Molekül ein Metallatom vorhanden ist, ist die Bindung ionisch. Sind im Molekül keine Metallatome vorhanden, ist die Bindung polar kovalent. - Metalle befinden sich links und in der Mitte des Periodensystems. In dieser Tabelle sind Metalle hervorgehoben.
- In unserem HF-Beispiel liegt die Differenz der Elektronegativitäten in diesem Bereich. Da H und F keine Metalle sind, ist die Bindung polare kovalente.
Methode 3 von 3: Berechnung der Mulliken-Elektronegativität
 1 Finden Sie die erste Ionisationsenergie eines Atoms. Die Mulliken-Elektronegativitätsskala unterscheidet sich geringfügig von der oben erwähnten Pauling-Skala. Die erste Ionisierungsenergie wird benötigt, um ein Atom aus einem Elektron zu entfernen.
1 Finden Sie die erste Ionisationsenergie eines Atoms. Die Mulliken-Elektronegativitätsskala unterscheidet sich geringfügig von der oben erwähnten Pauling-Skala. Die erste Ionisierungsenergie wird benötigt, um ein Atom aus einem Elektron zu entfernen. - Die Bedeutung einer solchen Energie findet sich beispielsweise in Chemie-Nachschlagewerken oder im Netz hier.
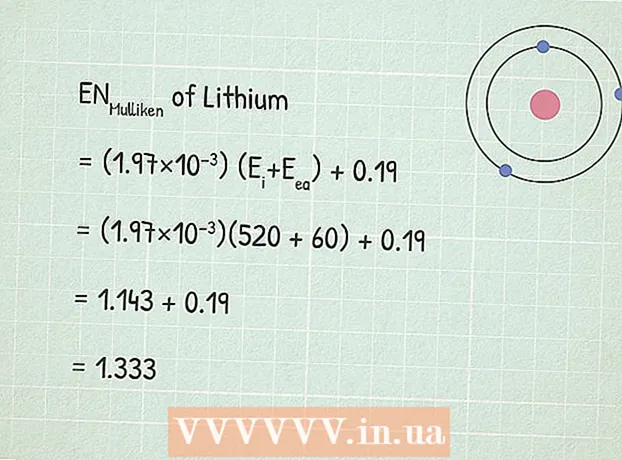
- Betrachten wir als Beispiel die Elektronegativität von Lithium (Li). Seine erste Ionisationsenergie ist 520 kJ / mol.
 2 Finden Sie die Affinitätsenergie für ein Elektron. Dies ist die Energie, die beim Anheften eines Elektrons an ein Atom freigesetzt wird. Die Bedeutung einer solchen Energie findet sich beispielsweise in Chemie-Nachschlagewerken oder im Netz hier.
2 Finden Sie die Affinitätsenergie für ein Elektron. Dies ist die Energie, die beim Anheften eines Elektrons an ein Atom freigesetzt wird. Die Bedeutung einer solchen Energie findet sich beispielsweise in Chemie-Nachschlagewerken oder im Netz hier. - Die Elektronenaffinitätsenergie von Lithium ist 60 kJ / mol.
 3 Verwenden Sie die Elektronegativitätsgleichung von Mulliken:RUMulliken = (1,97 × 10) (Eich+ Eea) + 0,19.
3 Verwenden Sie die Elektronegativitätsgleichung von Mulliken:RUMulliken = (1,97 × 10) (Eich+ Eea) + 0,19. - In unserem Beispiel:
- RUMulliken = (1,97 × 10) (Eich+ Eea) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- In unserem Beispiel:
Tipps
- Neben den Pauling- und Mulliken-Skalen gibt es Elektronegativitäts-Skalen nach Allred-Rochow, Sanderson, Allen. Sie alle haben ihre eigenen Formeln zur Berechnung der Elektronegativität (einige von ihnen sind ziemlich kompliziert).
- Die Elektronegativität hat keine Maßeinheiten.



