Autor:
Clyde Lopez
Erstelldatum:
26 Juli 2021
Aktualisierungsdatum:
1 Juli 2024
Inhalt
- Schritte
- Methode 1 von 4: Berechnung des Prozentsatzes mithilfe einer Gewichts-/Volumenformel
- Methode 2 von 4: Herstellung einer molekularen Lösung
- Methode 3 von 4: Verdünnen von Lösungen bekannter Konzentration
- Methode 4 von 4: Einhaltung der Sicherheitsvorkehrungen
- Tipps
- Warnungen
- Was brauchst du
Einfache chemische Lösungen lassen sich zu Hause oder am Arbeitsplatz auf vielfältige Art und Weise herstellen. Egal, ob Sie eine Lösung aus einem pulverförmigen Material herstellen oder eine Flüssigkeit verdünnen, es ist einfach, die richtige Menge jeder Komponente zu bestimmen. Denken Sie bei der Herstellung chemischer Lösungen daran, persönliche Schutzausrüstung zu verwenden, um Schäden zu vermeiden.
Schritte
Methode 1 von 4: Berechnung des Prozentsatzes mithilfe einer Gewichts-/Volumenformel
 1 Definieren Prozentsatz Inhalt auf Gewicht/ Volumen der Lösung. Prozentangaben geben an, wie viele Teile eines Stoffes in hundert Teilen einer Lösung enthalten sind. Bei Anwendung auf chemische Lösungen bedeutet dies, dass bei einer Konzentration von 1 Prozent 100 Milliliter Lösung 1 Gramm der Substanz enthalten, dh 1 ml / 100 ml.
1 Definieren Prozentsatz Inhalt auf Gewicht/ Volumen der Lösung. Prozentangaben geben an, wie viele Teile eines Stoffes in hundert Teilen einer Lösung enthalten sind. Bei Anwendung auf chemische Lösungen bedeutet dies, dass bei einer Konzentration von 1 Prozent 100 Milliliter Lösung 1 Gramm der Substanz enthalten, dh 1 ml / 100 ml. - Zum Beispiel nach Gewicht: Eine 10 gewichtsprozentige Lösung enthält 10 Gramm des Stoffes gelöst in 100 Milliliter Lösung.
- Zum Beispiel nach Volumen: Eine 23-prozentige Lösung nach Volumen enthält 23 Milliliter flüssige Verbindung auf 100 Milliliter Lösung.
 2 Bestimmen Sie das Volumen der Lösung, die Sie herstellen möchten. Um die benötigte Masse eines Stoffes zu ermitteln, müssen Sie zunächst das Endvolumen der benötigten Lösung ermitteln. Dieses Volumen hängt davon ab, wie viel Lösung Sie benötigen, wie oft Sie sie verwenden und wie stabil die fertige Lösung ist.
2 Bestimmen Sie das Volumen der Lösung, die Sie herstellen möchten. Um die benötigte Masse eines Stoffes zu ermitteln, müssen Sie zunächst das Endvolumen der benötigten Lösung ermitteln. Dieses Volumen hängt davon ab, wie viel Lösung Sie benötigen, wie oft Sie sie verwenden und wie stabil die fertige Lösung ist. - Wenn Sie jedes Mal eine frische Lösung verwenden müssen, bereiten Sie nur die Menge vor, die Sie für eine Anwendung benötigen.
- Wenn die Lösung ihre Eigenschaften lange behält, können Sie eine größere Menge vorbereiten, um sie später zu verwenden.
- Beispiel: Sie müssen eine 5%ige NaCl-Lösung mit einem Volumen von 500 ml herstellen.
 3 Berechnen Sie die Grammzahl der Substanz, die zur Herstellung der Lösung benötigt wird. Um die erforderliche Grammzahl zu berechnen, verwenden Sie die folgende Formel: Grammzahl = (erforderlicher Prozentsatz) (erforderliches Volumen / 100 ml). In diesem Fall werden die erforderlichen Prozentsätze in Gramm und das erforderliche Volumen in Millilitern ausgedrückt.
3 Berechnen Sie die Grammzahl der Substanz, die zur Herstellung der Lösung benötigt wird. Um die erforderliche Grammzahl zu berechnen, verwenden Sie die folgende Formel: Grammzahl = (erforderlicher Prozentsatz) (erforderliches Volumen / 100 ml). In diesem Fall werden die erforderlichen Prozentsätze in Gramm und das erforderliche Volumen in Millilitern ausgedrückt. - Beispiel: Sie müssen eine 5%ige NaCl-Lösung mit einem Volumen von 500 ml herstellen.
- Grammzahl = (5g) (500ml / 100ml) = 25 Gramm.
- Wenn NaCl als Lösung verabreicht wird, nehmen Sie einfach 25 Milliliter NaCl anstelle von Gramm Pulver und ziehen dieses Volumen vom Endvolumen ab: 25 Milliliter NaCl auf 475 Milliliter Wasser.
 4 Wiegen Sie die Substanz. Nachdem Sie die erforderliche Masse des Stoffes berechnet haben, sollten Sie diese Menge messen. Nehmen Sie eine kalibrierte Waage, stellen Sie eine Schüssel darauf und stellen Sie den Nullpunkt ein. Wiegen Sie die benötigte Stoffmenge in Gramm ab und gießen Sie sie aus.
4 Wiegen Sie die Substanz. Nachdem Sie die erforderliche Masse des Stoffes berechnet haben, sollten Sie diese Menge messen. Nehmen Sie eine kalibrierte Waage, stellen Sie eine Schüssel darauf und stellen Sie den Nullpunkt ein. Wiegen Sie die benötigte Stoffmenge in Gramm ab und gießen Sie sie aus. - Bevor Sie mit der Zubereitung der Lösung fortfahren, reinigen Sie die Waagschale unbedingt von Pulverresten.
- Im obigen Beispiel müssen Sie 25 Gramm NaCl wiegen.
 5 Lösen Sie die Substanz in der erforderlichen Flüssigkeitsmenge auf. Als Lösungsmittel wird, wenn nicht anders angegeben, Wasser verwendet. Nehmen Sie ein Messglas und messen Sie die erforderliche Flüssigkeitsmenge ab. Anschließend das Pulvermaterial in der Flüssigkeit auflösen.
5 Lösen Sie die Substanz in der erforderlichen Flüssigkeitsmenge auf. Als Lösungsmittel wird, wenn nicht anders angegeben, Wasser verwendet. Nehmen Sie ein Messglas und messen Sie die erforderliche Flüssigkeitsmenge ab. Anschließend das Pulvermaterial in der Flüssigkeit auflösen. - Unterschreiben Sie den Behälter, in dem Sie die Lösung aufbewahren. Geben Sie den Stoff und seine Konzentration deutlich an.
- Beispiel: Lösen Sie 25 Gramm NaCl in 500 Milliliter Wasser auf, um eine 5%ige Lösung herzustellen.
- Denken Sie daran, dass wenn Sie eine flüssige Substanz verdünnen, um die erforderliche Wassermenge zu erhalten, das Volumen der hinzugefügten Substanz vom Endvolumen der Lösung abziehen: 500 ml - 25 ml = 475 ml Wasser.
Methode 2 von 4: Herstellung einer molekularen Lösung
 1 Bestimmen Sie das Molekulargewicht der verwendeten Substanz anhand der Formel. Das Formelgewicht (oder einfach das Molekulargewicht) einer Verbindung wird in Gramm pro Mol (g/mol) an die Flaschenwand geschrieben. Wenn Sie das Molekulargewicht auf der Flasche nicht finden können, schauen Sie online nach.
1 Bestimmen Sie das Molekulargewicht der verwendeten Substanz anhand der Formel. Das Formelgewicht (oder einfach das Molekulargewicht) einer Verbindung wird in Gramm pro Mol (g/mol) an die Flaschenwand geschrieben. Wenn Sie das Molekulargewicht auf der Flasche nicht finden können, schauen Sie online nach. - Das Molekulargewicht einer Substanz ist die Masse (in Gramm) eines Mols dieser Substanz.
- Beispiel: Das Molekulargewicht von Natriumchlorid (NaCl) beträgt 58,44 g/mol.
 2 Bestimmen Sie das Volumen der benötigten Lösung in Litern. Es ist sehr einfach, einen Liter Lösung herzustellen, da seine Molarität in Mol / Liter angegeben wird, jedoch kann es erforderlich sein, je nach Verwendungszweck der Lösung mehr oder weniger Liter herzustellen. Verwenden Sie das Endvolumen, um die erforderliche Grammzahl zu berechnen.
2 Bestimmen Sie das Volumen der benötigten Lösung in Litern. Es ist sehr einfach, einen Liter Lösung herzustellen, da seine Molarität in Mol / Liter angegeben wird, jedoch kann es erforderlich sein, je nach Verwendungszweck der Lösung mehr oder weniger Liter herzustellen. Verwenden Sie das Endvolumen, um die erforderliche Grammzahl zu berechnen. - Beispiel: Es müssen 50 ml einer Lösung mit einem molaren Anteil von NaCl von 0,75 hergestellt werden.
- Um Milliliter in Liter umzurechnen, dividiere sie durch 1000 und erhalte 0,05 Liter.
 3 Berechnen Sie die Grammzahl, die erforderlich ist, um die erforderliche molekulare Lösung herzustellen. Verwenden Sie dazu folgende Formel: Grammzahl = (erforderliches Volumen) (erforderliche Molarität) (Molekulargewicht gemäß Formel). Denken Sie daran, dass das erforderliche Volumen in Litern ausgedrückt wird, die Molarität in Mol pro Liter und das Molekulargewicht gemäß der Formel in Gramm pro Mol.
3 Berechnen Sie die Grammzahl, die erforderlich ist, um die erforderliche molekulare Lösung herzustellen. Verwenden Sie dazu folgende Formel: Grammzahl = (erforderliches Volumen) (erforderliche Molarität) (Molekulargewicht gemäß Formel). Denken Sie daran, dass das erforderliche Volumen in Litern ausgedrückt wird, die Molarität in Mol pro Liter und das Molekulargewicht gemäß der Formel in Gramm pro Mol. - Beispiel: Wenn Sie 50 Milliliter einer Lösung mit einem molaren Anteil von NaCl 0,75 (Molekulargewicht nach Formel: 58,44 g / mol) herstellen möchten, sollten Sie die Grammzahl NaCl berechnen.
- Grammzahl = 0,05 l * 0,75 mol / l * 58,44 g / mol = 2,19 Gramm NaCl.
- Durch die Reduzierung der Maßeinheiten erhält man Gramm Substanz.
 4 Wiegen Sie die Substanz. Wiegen Sie die erforderliche Menge mit einer richtig kalibrierten Waage ab. Stellen Sie eine Schüssel auf die Waage und nullen Sie vor dem Wiegen. Geben Sie die Substanz in die Schüssel, bis Sie die gewünschte Masse erreicht haben.
4 Wiegen Sie die Substanz. Wiegen Sie die erforderliche Menge mit einer richtig kalibrierten Waage ab. Stellen Sie eine Schüssel auf die Waage und nullen Sie vor dem Wiegen. Geben Sie die Substanz in die Schüssel, bis Sie die gewünschte Masse erreicht haben. - Reinigen Sie die Waagschale nach Gebrauch.
- Beispiel: 2,19 Gramm NaCl wiegen.
 5 Lösen Sie das Pulver in der erforderlichen Flüssigkeitsmenge auf. Sofern nicht anders angegeben, verwenden die meisten Lösungen Wasser. In diesem Fall wird dasselbe Flüssigkeitsvolumen verwendet, mit dem die Masse des Stoffes berechnet wurde. Substanz in Wasser geben und rühren, bis sie sich vollständig aufgelöst hat.
5 Lösen Sie das Pulver in der erforderlichen Flüssigkeitsmenge auf. Sofern nicht anders angegeben, verwenden die meisten Lösungen Wasser. In diesem Fall wird dasselbe Flüssigkeitsvolumen verwendet, mit dem die Masse des Stoffes berechnet wurde. Substanz in Wasser geben und rühren, bis sie sich vollständig aufgelöst hat. - Signieren Sie den Container mit der Lösung. Beschriften Sie den gelösten Stoff und die Molarität deutlich, damit Sie die Lösung später verwenden können.
- Beispiel: Mit einem Becherglas (Volumenmessgerät) 50 ml Wasser abmessen und darin 2,19 Gramm NaCl lösen.
- Rühren Sie die Lösung, bis das Pulver vollständig aufgelöst ist.
Methode 3 von 4: Verdünnen von Lösungen bekannter Konzentration
 1 Bestimmen Sie die Konzentration jeder Lösung. Beim Verdünnen von Lösungen müssen Sie die Konzentration der Originallösung und die gewünschte Lösung kennen.Diese Methode eignet sich zum Verdünnen konzentrierter Lösungen.
1 Bestimmen Sie die Konzentration jeder Lösung. Beim Verdünnen von Lösungen müssen Sie die Konzentration der Originallösung und die gewünschte Lösung kennen.Diese Methode eignet sich zum Verdünnen konzentrierter Lösungen. - Beispiel: Aus einer 5 M Lösung 75 ml 1,5 M NaCl-Lösung herstellen Die Stammlösung hat eine Konzentration von 5 M und muss auf eine Konzentration von 1,5 M verdünnt werden.
 2 Bestimmen Sie das Volumen der endgültigen Lösung. Es ist notwendig, das Volumen der Lösung zu finden, die Sie erhalten möchten. Sie müssen die Lösungsmenge berechnen, die erforderlich ist, um diese Lösung auf die gewünschte Konzentration und das gewünschte Volumen zu verdünnen.
2 Bestimmen Sie das Volumen der endgültigen Lösung. Es ist notwendig, das Volumen der Lösung zu finden, die Sie erhalten möchten. Sie müssen die Lösungsmenge berechnen, die erforderlich ist, um diese Lösung auf die gewünschte Konzentration und das gewünschte Volumen zu verdünnen. - Beispiel: Bereiten Sie 75 Milliliter einer 1,5 M NaCl-Lösung aus einer anfänglichen 5 M-Lösung vor. In diesem Beispiel beträgt das endgültige Lösungsvolumen 75 Milliliter.
 3 Berechnen Sie das Lösungsvolumen, das zum Verdünnen der Ausgangslösung benötigt wird. Dazu benötigen Sie folgende Formel: V1C1= V2C2wo V1 - das Volumen der benötigten Lösung, C1 - seine Konzentration, V2 - Volumen der Endlösung, C2 - seine Konzentration.
3 Berechnen Sie das Lösungsvolumen, das zum Verdünnen der Ausgangslösung benötigt wird. Dazu benötigen Sie folgende Formel: V1C1= V2C2wo V1 - das Volumen der benötigten Lösung, C1 - seine Konzentration, V2 - Volumen der Endlösung, C2 - seine Konzentration. - Um das Volumen des benötigten Fluids zu berechnen, muss die Gleichheit bezüglich V . umgeschrieben werden1: V1 = (V2C2) / C1.
- Beispiel: Sie müssen aus einer Lösung mit einer Konzentration von 5 M eine 75 ml NaCl-Lösung mit einer Konzentration von 1,5 M herstellen.
- V1 = (V2C2) / C1 = (0,075 l * 1,5 Mio.) / 5 Mio. = 0,0225 l.
- Konvertieren Sie Liter zurück in Milliliter, indem Sie mit 1000 multiplizieren, um 22,5 Milliliter zu erhalten.
 4 Ziehen Sie das Volumen der ursprünglichen Lösung vom geplanten Endvolumen ab. Aufgrund der Verdünnung der Lösung ist es notwendig, ein festes Endvolumen zu erhalten. Ziehen Sie das Volumen der Stammlösung vom Endvolumen ab, um das Volumen der Verdünnungslösung zu bestimmen.
4 Ziehen Sie das Volumen der ursprünglichen Lösung vom geplanten Endvolumen ab. Aufgrund der Verdünnung der Lösung ist es notwendig, ein festes Endvolumen zu erhalten. Ziehen Sie das Volumen der Stammlösung vom Endvolumen ab, um das Volumen der Verdünnungslösung zu bestimmen. - Beispiel: Das Endvolumen beträgt 75 Milliliter und das Originalvolumen 22,5 Milliliter. Somit erhalten wir 75 - 22,5 = 52,5 Milliliter. Dieses Flüssigkeitsvolumen wird benötigt, um die Lösung zu verdünnen.
 5 Mischen Sie die berechnete Menge der Stammlösung mit der Verdünnungsflüssigkeit. Mit einem Becherglas (Gerät zum Messen des Flüssigkeitsvolumens) die erforderliche Menge der Stammlösung abmessen und mit der erforderlichen Menge der Verdünnungsflüssigkeit mischen.
5 Mischen Sie die berechnete Menge der Stammlösung mit der Verdünnungsflüssigkeit. Mit einem Becherglas (Gerät zum Messen des Flüssigkeitsvolumens) die erforderliche Menge der Stammlösung abmessen und mit der erforderlichen Menge der Verdünnungsflüssigkeit mischen. - Beispiel: 22,5 Milliliter einer 5 M NaCl-Stammlösung abmessen und mit 52,5 Milliliter Wasser verdünnen. Rühren Sie die Lösung um.
- Schreiben Sie auf den Behälter mit der verdünnten Lösung deren Konzentration und Zusammensetzung: 1,5 M NaCl.
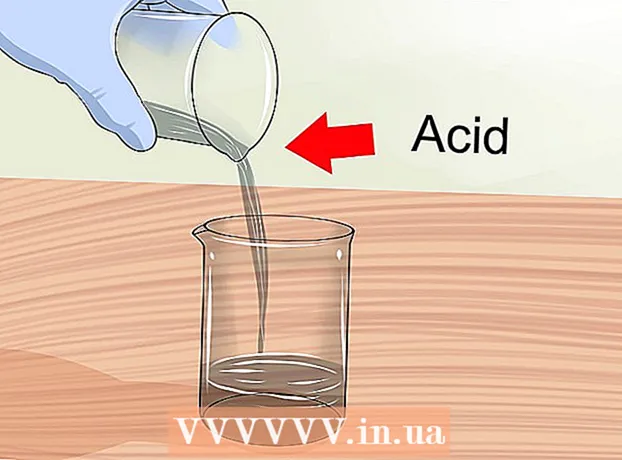
- Denken Sie daran, wenn Sie Säure mit Wasser verdünnen, sollten Sie dem Wasser Säure hinzufügen, aber niemals umgekehrt.
Methode 4 von 4: Einhaltung der Sicherheitsvorkehrungen
 1 Persönliche Schutzausrüstung verwenden. Schützen Sie sich beim Arbeiten mit aggressiven Chemikalien und Lösungen vor deren Auswirkungen. Tragen Sie unbedingt einen Laborkittel, geschlossene Schuhe, Schutzbrille und Handschuhe.
1 Persönliche Schutzausrüstung verwenden. Schützen Sie sich beim Arbeiten mit aggressiven Chemikalien und Lösungen vor deren Auswirkungen. Tragen Sie unbedingt einen Laborkittel, geschlossene Schuhe, Schutzbrille und Handschuhe. - Verwenden Sie einen Laborkittel aus nicht brennbarem Material.
- Schutzbrillen sollten Seitenschilder haben, die die Augen von der Seite abdecken.
 2 Arbeiten Sie in einem gut belüfteten Bereich. Beim Mischen der Lösungen können flüchtige Gase freigesetzt werden. Einige Stoffe sollten nur unter einer Laborhaube gehandhabt werden. Wenn Sie zu Hause Lösungen mischen, öffnen Sie die Fenster und schalten Sie einen Ventilator ein, um eine ausreichende Luftzirkulation zu gewährleisten.
2 Arbeiten Sie in einem gut belüfteten Bereich. Beim Mischen der Lösungen können flüchtige Gase freigesetzt werden. Einige Stoffe sollten nur unter einer Laborhaube gehandhabt werden. Wenn Sie zu Hause Lösungen mischen, öffnen Sie die Fenster und schalten Sie einen Ventilator ein, um eine ausreichende Luftzirkulation zu gewährleisten.  3 Säure in Wasser geben. Beim Verdünnen konzentrierter Säuren immer die Säure zum Wasser geben. Beim Mischen von Wasser und Säure kommt es zu einer exothermen (unter Wärmefreisetzung) Reaktion, die bei Zugabe von Wasser zur Säure zu einer Explosion führen kann und nicht umgekehrt.
3 Säure in Wasser geben. Beim Verdünnen konzentrierter Säuren immer die Säure zum Wasser geben. Beim Mischen von Wasser und Säure kommt es zu einer exothermen (unter Wärmefreisetzung) Reaktion, die bei Zugabe von Wasser zur Säure zu einer Explosion führen kann und nicht umgekehrt. - Denken Sie bei jeder Arbeit mit Säuren an die Sicherheitsvorkehrungen.
Tipps
- Machen Sie sich vor Beginn mit dem Thema vertraut. Wissen ist Macht!
- Versuchen Sie es mit normalen Haushaltsprodukten. Versuchen Sie nicht, etwas Außergewöhnliches zu tun. Wenn Sie vermuten, dass eine Gefahr entstehen könnte, geben Sie auf.
Warnungen
- Mische kein Bleichmittel und Ammoniak.
- Verwenden Sie bei Bedarf Sicherheitsausrüstung, Schutzbrille, eine Plastikschürze und Neoprenhandschuhe.
Was brauchst du
- Präzise mechanische oder elektronische Waagen zur Bestimmung der Masse. Sie können beispielsweise eine Küchenwaage verwenden.
- Graduierte Glaswaren. Diese Utensilien können in einem Küchenutensiliengeschäft gefunden oder online bestellt werden. Messgläser gibt es in verschiedenen Formen und Größen. Plastikgeschirr funktioniert, obwohl es hohen Temperaturen nicht standhält.