Autor:
Helen Garcia
Erstelldatum:
17 April 2021
Aktualisierungsdatum:
1 Juli 2024
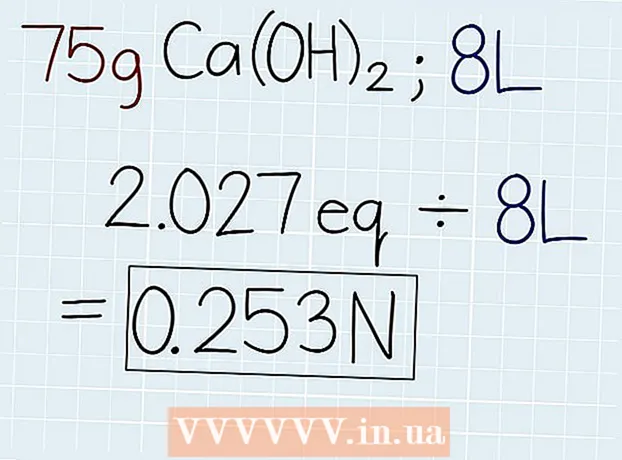
Inhalt
- Schritte
- Methode 1 von 2: Berechnung der Normalität über Molarität
- Methode 2 von 2: Berechnung der Normalität in der äquivalenten Masse
- Tipps
- Was brauchst du
Normalität gibt die Konzentration von Säure oder Alkali in einer Lösung an. Um die Normalität einer Lösung herauszufinden, können sowohl die Molarität als auch die äquivalente Masse des Moleküls in die Berechnungen einbezogen werden. Wenn Sie sich für die Molarität entscheiden, verwenden Sie die Formel N = M (n), wobei M die Molarität und n die Anzahl der Wasserstoff- oder Hydroxidmoleküle ist. Wenn Sie sich für die Äquivalentmasse entscheiden, verwenden Sie die Formel N = eq ÷ V, wobei eq die Anzahl der Äquivalente und V das Volumen der Lösung ist.
Schritte
Methode 1 von 2: Berechnung der Normalität über Molarität
 1 Addieren Sie die Molmasse aller Komponenten der Lösung. Finden Sie die Elemente der chemischen Formel im Periodensystem, um ihre Atommasse zu ermitteln, die der Molmasse entspricht. Schreiben Sie die Molmasse jedes Elements auf und multiplizieren Sie sie mit der Anzahl dieser Elemente. Addieren Sie die Molmasse aller Komponenten, um die Gesamtmolmasse zu erhalten.
1 Addieren Sie die Molmasse aller Komponenten der Lösung. Finden Sie die Elemente der chemischen Formel im Periodensystem, um ihre Atommasse zu ermitteln, die der Molmasse entspricht. Schreiben Sie die Molmasse jedes Elements auf und multiplizieren Sie sie mit der Anzahl dieser Elemente. Addieren Sie die Molmasse aller Komponenten, um die Gesamtmolmasse zu erhalten. - Wenn Sie beispielsweise die Molmasse von Schwefelsäure (H2SO4), ermitteln Sie die Molmasse von Wasserstoff (1 g), Schwefel (3 g) und Sauerstoff (16 g).
- Multiplizieren Sie die Masse mit der Anzahl der Komponenten in der Zusammensetzung. In unserem Beispiel gibt es 2 Wasserstoffatome und 4 Sauerstoffatome. Die Gesamtmolmasse von Wasserstoff beträgt 2 x 1 g = 2 g. Die Molmasse von Sauerstoff in dieser Lösung beträgt 4 x 16 g = 64 g.
- Addiere alle Molmassen zusammen. Sie erhalten 2 g + 32 g + 64 g = 98 g / mol.
- Wenn Sie die Molarität der gesuchten Lösung bereits kennen, gehen Sie direkt zu Schritt 4.
 2 Teilen Sie die tatsächliche Masse der Lösung durch die Molmasse. Ermitteln Sie das tatsächliche Gewicht der Lösung. Es wird entweder auf dem Container mit der Lösung oder in der Aufgabe selbst angezeigt.Dann dividiere die Masse der Lösung durch die zuvor gefundene Gesamtmolmasse. Das Ergebnis ist die Anzahl der Mole in der Lösung, nach der „Mol“ geschrieben werden sollte.
2 Teilen Sie die tatsächliche Masse der Lösung durch die Molmasse. Ermitteln Sie das tatsächliche Gewicht der Lösung. Es wird entweder auf dem Container mit der Lösung oder in der Aufgabe selbst angezeigt.Dann dividiere die Masse der Lösung durch die zuvor gefundene Gesamtmolmasse. Das Ergebnis ist die Anzahl der Mole in der Lösung, nach der „Mol“ geschrieben werden sollte. - Wenn Sie beispielsweise versuchen, die Normalität von 100 g H2SO4in 12 Liter Flüssigkeit aufgelöst, die tatsächliche Masse verwenden und durch Molar dividieren. Als Ergebnis erhalten Sie: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 Mol entspricht 6,02 x 10 Atomen oder Molekülen einer Lösung.
 3 Teilen Sie das Ergebnis durch das Volumen der Lösung in Litern, um die Molarität zu ermitteln. Nehmen Sie die soeben berechnete Molzahl der Lösung und dividieren Sie sie durch das Gesamtvolumen der zu messenden Lösung. Als Ergebnis kennen Sie die Molarität (M), mit der Sie die Konzentration der Lösung ermitteln können.
3 Teilen Sie das Ergebnis durch das Volumen der Lösung in Litern, um die Molarität zu ermitteln. Nehmen Sie die soeben berechnete Molzahl der Lösung und dividieren Sie sie durch das Gesamtvolumen der zu messenden Lösung. Als Ergebnis kennen Sie die Molarität (M), mit der Sie die Konzentration der Lösung ermitteln können. - Basierend auf unserem Beispiel erhalten wir folgende Formel: 1.02 mol ÷ 12 L = 0.085 M.
Beratung: Achten Sie darauf, das Volumen der Lösung in Liter umzurechnen, falls Sie dies noch nicht getan haben. Andernfalls erhalten Sie die falsche Antwort.
 4 Multiplizieren Sie die Molarität mit der Anzahl der Wasserstoff- oder Hydroxidmoleküle. Schauen Sie sich die chemische Formel an, um die Anzahl der Wasserstoffatome (H) in einer Säure oder Hydroxidmoleküle in (OH) in der Base herauszufinden. Dann multiplizieren Sie die Molarität der Lösung mit der Anzahl der Wasserstoff- oder Hydroxidmoleküle in dieser Lösung, um die normale Konzentration oder Normalität zu finden. Schreiben Sie am Ende Ihrer Antwort die Abkürzung "N".
4 Multiplizieren Sie die Molarität mit der Anzahl der Wasserstoff- oder Hydroxidmoleküle. Schauen Sie sich die chemische Formel an, um die Anzahl der Wasserstoffatome (H) in einer Säure oder Hydroxidmoleküle in (OH) in der Base herauszufinden. Dann multiplizieren Sie die Molarität der Lösung mit der Anzahl der Wasserstoff- oder Hydroxidmoleküle in dieser Lösung, um die normale Konzentration oder Normalität zu finden. Schreiben Sie am Ende Ihrer Antwort die Abkürzung "N". - In unserem Beispiel wird Schwefelsäure (H2SO4) 2 Wasserstoffatome. Die Formel lautet also: 0,085 M x 2 = 0,17 N.
- In einem anderen Beispiel hat Natriumhydroxid (NaOH) mit einer Molarität von 2 M nur 1 Hydroxidmolekül. Daher lautet die Formel wie folgt: 2 M x 1 = 2 N.
Methode 2 von 2: Berechnung der Normalität in der äquivalenten Masse
 1 Ermitteln Sie die Gesamtmolmasse der Lösung. Schauen Sie sich die chemische Formel der Lösung an und finden Sie jedes Element im Periodensystem. Schreiben Sie die Molmasse jedes Elements auf und multiplizieren Sie sie mit der Anzahl dieser Elemente in der Formel. Addieren Sie alle Molmassen zusammen, um die Gesamtmolmasse in Gramm zu erhalten.
1 Ermitteln Sie die Gesamtmolmasse der Lösung. Schauen Sie sich die chemische Formel der Lösung an und finden Sie jedes Element im Periodensystem. Schreiben Sie die Molmasse jedes Elements auf und multiplizieren Sie sie mit der Anzahl dieser Elemente in der Formel. Addieren Sie alle Molmassen zusammen, um die Gesamtmolmasse in Gramm zu erhalten. - Wenn Sie beispielsweise die Molmasse von Ca (OH) wissen möchten2, dann ermitteln Sie die Molmasse von Calcium (40 g), Sauerstoff (16 g) und Wasserstoff (1 g).
- In der Formel gibt es 2 Atome Sauerstoff und Wasserstoff. Die Gesamtmasse des Sauerstoffs beträgt: 2 x 16 g = 32 g Die Molmasse des Wasserstoffs beträgt: 2 x 1 g = 2 g.
- Addiere alle Molmassen zusammen, um 40 g + 32 g + 2 g = 74 g / mol zu erhalten.
 2 Teilen Sie die Molmasse durch die Anzahl der Wasserstoff- oder Hydroxidmoleküle. Finden Sie die Anzahl der Wasserstoffatome (H) in einer Säure oder Hydroxid (OH) Moleküle in der Base heraus. Teilen Sie die soeben erhaltene Gesamtmolmasse durch die Anzahl der Atome oder Moleküle, um das Gewicht von 1 Äquivalent zu ermitteln, das der Masse von 1 Mol Wasserstoff oder Hydroxid entspricht. Schreiben Sie am Ende der Antwort die Abkürzung "G.-e.", die die Masse des Äquivalents bedeutet.
2 Teilen Sie die Molmasse durch die Anzahl der Wasserstoff- oder Hydroxidmoleküle. Finden Sie die Anzahl der Wasserstoffatome (H) in einer Säure oder Hydroxid (OH) Moleküle in der Base heraus. Teilen Sie die soeben erhaltene Gesamtmolmasse durch die Anzahl der Atome oder Moleküle, um das Gewicht von 1 Äquivalent zu ermitteln, das der Masse von 1 Mol Wasserstoff oder Hydroxid entspricht. Schreiben Sie am Ende der Antwort die Abkürzung "G.-e.", die die Masse des Äquivalents bedeutet. - In unserem Beispiel Ca(OH)2 2 zwei Wasserstoffmoleküle, was bedeutet, dass die Masse des Äquivalents 74 g / mol 2 = 37 G.-e beträgt.
 3 Dividiere das tatsächliche Gewicht der Lösung durch das Äquivalentgewicht. Nachdem Sie die Masse des Äquivalents kennen, teilen Sie diese durch die Masse der Lösung, die auf dem Behälter mit der Lösung oder in der zu lösenden Aufgabe angegeben ist. Die Antwort ist die Anzahl der Äquivalente in der Lösung, damit Sie dann die Normalität berechnen können. Geben Sie am Ende der Antwort die Abkürzung "e" ein.
3 Dividiere das tatsächliche Gewicht der Lösung durch das Äquivalentgewicht. Nachdem Sie die Masse des Äquivalents kennen, teilen Sie diese durch die Masse der Lösung, die auf dem Behälter mit der Lösung oder in der zu lösenden Aufgabe angegeben ist. Die Antwort ist die Anzahl der Äquivalente in der Lösung, damit Sie dann die Normalität berechnen können. Geben Sie am Ende der Antwort die Abkürzung "e" ein. - Wenn in unserem Beispiel 75 g Ca (OH)2, dann lautet die Formel: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Teilen Sie die Anzahl der Äquivalente durch das Volumen der Lösung in Litern. Ermitteln Sie das Gesamtvolumen der Lösung und schreiben Sie die Antwort in Litern auf. Nehmen Sie die soeben erhaltene Anzahl von Äquivalenten und teilen Sie sie durch das Volumen der Lösung, um die Normalität zu ermitteln. Fügen Sie am Ende Ihrer Antwort eine Abkürzung "N" ein.
4 Teilen Sie die Anzahl der Äquivalente durch das Volumen der Lösung in Litern. Ermitteln Sie das Gesamtvolumen der Lösung und schreiben Sie die Antwort in Litern auf. Nehmen Sie die soeben erhaltene Anzahl von Äquivalenten und teilen Sie sie durch das Volumen der Lösung, um die Normalität zu ermitteln. Fügen Sie am Ende Ihrer Antwort eine Abkürzung "N" ein. - Wenn 75 g Ca (OH) in einer Lösung mit einem Volumen von 8 Litern vorhanden sind2, dann dividiere die Anzahl der Äquivalente wie folgt durch das Volumen: 2.027 Oe. ÷ 8 l = 0,253 N.
Tipps
- Normale Konzentration oder Normalität wird üblicherweise verwendet, um Säuren und Basen zu messen. Wenn Sie die Konzentration einer anderen Lösung bestimmen müssen, geschieht dies normalerweise durch Messung der Molarität.
Was brauchst du
- Periodensystem
- Taschenrechner