Autor:
Randy Alexander
Erstelldatum:
25 April 2021
Aktualisierungsdatum:
26 Juni 2024
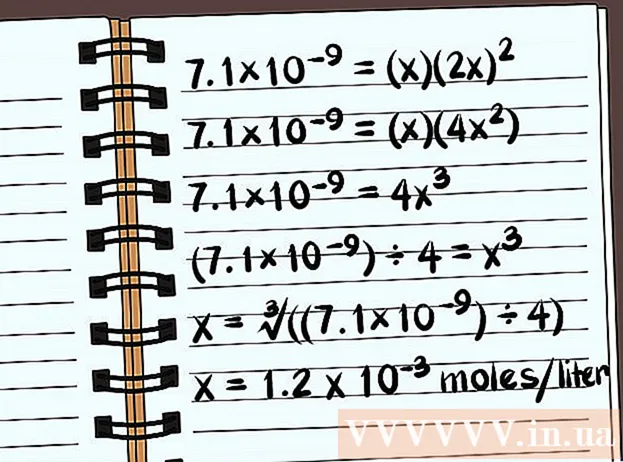
Inhalt
In der Chemie wird die Löslichkeit verwendet, um die Eigenschaften einer festen Verbindung zu beschreiben, wenn sie vollständig in einer Flüssigkeit gelöst ist, ohne unlösliche Rückstände zu hinterlassen. Nur ionische Verbindungen (geladen) sind löslich. Tatsächlich müssen Sie sich nur einige Prinzipien merken oder in der Literatur nachsehen, ob eine ionische Verbindung bei Zugabe zu Wasser fest bleibt oder ob sich eine große Menge auflöst. Tatsächlich löst sich eine bestimmte Menge an Molekülen auf, selbst wenn Sie keine Änderung feststellen. Damit das Experiment genau ist, müssen Sie wissen, wie diese Menge an gelöstem Stoff berechnet wird.
Schritte
Methode 1 von 2: Verwenden Sie schnelle Regeln
Erfahren Sie mehr über ionische Verbindungen. Jedes Atom hat normalerweise eine bestimmte Anzahl von Elektronen, aber manchmal bekommt oder gibt es ein Elektron ab. Dieser Prozess macht es eins Ionen berechnet. Wenn ein Ion mit einer negativen Ladung (Überschuss eines Elektrons) auf ein Ion mit einer positiven Ladung trifft (ein Elektron fehlt), verbinden sie sich wie die Kathode und Anode zweier Magnete. Das Ergebnis bildet eine ionische Verbindung.
- Ionen haben eine negative Ladung genannt Anionenund Ionen haben eine positive Ladung genannt Kation.
- Normalerweise entspricht die Anzahl der Elektronen in einem Atom der Anzahl der Protonen, daher ist es nicht geladen.

Löslichkeit verstehen. Wassermolekül (H.2O) hat eine unregelmäßige Struktur, so dass es einem Magneten ähnelt: Ein Ende hat eine positive Ladung und das andere eine negative Ladung. Wenn Sie eine ionische Verbindung in Wasser geben, sammeln sich diese Wassermagnete um sie herum und versuchen, die positiven und negativen Ionen auseinander zu ziehen.- Einige ionische Verbindungen werden nicht sehr stark absorbiert, sie werden berücksichtigt löslich Weil es sich trennt und auflöst, wenn es zu Wasser gegeben wird. Andere Verbindungen haben stärkere Bindungen unlöslich weil die Ionen unabhängig von der Anziehungskraft des Wassermoleküls eng voneinander angezogen werden.
- Einige Verbindungen haben eine Bindungskraft, die der Anziehung eines Wassermoleküls entspricht. Sie werden berücksichtigt schwach löslich weil die meisten Verbindungen getrennt werden, aber der Rest wird immer noch voneinander angezogen.

Verstehe das Prinzip der Auflösung. Da die Wechselwirkungen zwischen Atomen so komplex sind, können Sie sich nicht vollständig auf die Intuition verlassen, um zu unterscheiden, welche Verbindungen können oder nicht. Suchen Sie das erste Ion in der Verbindung in der Liste unten nach seinen gemeinsamen Eigenschaften und suchen Sie nach Ausnahmen, um sicherzustellen, dass das zweite Ion nicht abnormal mit ihm interagiert.- Zum Beispiel zur Überprüfung von Strontiumchlorid (SrCl2), bitte suchen Sie in den folgenden Schritten nach Sr oder Cl. Cl ist "normalerweise löslich", prüfen Sie daher, ob darunter Ausnahmen liegen. Sr ist nicht in der Ausnahmeliste, also SrCl2 muss löslich sein.
- Die häufigsten Ausnahmen zu jeder Regel sind unter der Regel angegeben. Es gibt andere Ausnahmen, aber es ist unwahrscheinlich, dass diese während der normalen Chemie oder der Laborstunden auftreten.

Verbindungen sind löslich, wenn sie Alkalimetalle wie Li, Na, K, Rb und Cs enthalten. Diese Metalle werden auch als Elemente der Gruppe IA bezeichnet: Lithium, Natrium, Kalium, Rubidium und Cäsium. Fast alle Verbindungen, die eines dieser Ionen enthalten, sind löslich.- Ausnahme: Li3PO4 unlöslich.
KEINE Verbindungen3, C.2H.3Ö2, NEIN2, ClO3 und ClO4 sind alle löslich. Die Namen, die den obigen Ionen entsprechen, sind Nitrat, Acetat, Nitrit, Chlorat und Perchlorat. Beachten Sie, dass Acetat häufig als OAc abgekürzt wird.
- Ausnahme: Ag (OAc) (Silberacetat) und Hg (OAc)2 (Quecksilberacetat) unlöslich.
- AgNO2 und KClO4 nur "leicht geschmolzen".
Die Verbindungen von Cl, Br und I sind üblicherweise löslich. Chlorid-, Bromid- und Iodidionen bilden fast immer lösliche Verbindungen, sogenannte Halogensalze.
- Ausnahme: Wenn sich eines der obigen Ionen mit Silberionen Ag verbindet, wird Quecksilber Hg2oder Pb-Blei bilden unlösliche Verbindungen. Gleiches gilt für die weniger verbreiteten Verbindungen, die in Kombination mit Kupfer-Cu und Thali-Tl gebildet werden.
SO enthaltende Verbindungen4 normalerweise löslich. Sulfationen bilden oft lösliche Verbindungen, aber es gibt viele Ausnahmen.
- Ausnahme: Sulfationen bilden mit den folgenden Ionen eine unlösliche Verbindung: Strontium Sr, Barium Ba, Blei Pb, Silber Ag, Calcium Ca, Radium Ra und Silber Monatom Ag2. Beachten Sie, dass Silbersulfat und Calciumsulfat nur mäßig löslich sind, so dass einige sie als schwer löslich betrachten.
Substanzen, die OH oder S enthalten, sind unlöslich. Die entsprechenden Namen für diese Ionen sind Hydroxide und Sulfide.
- Ausnahme: Erinnern Sie sich an Alkalimetalle (Gruppen I-A) und wie sie gerne lösliche Verbindungen bilden? Li, Na, K, Rb und Cs bilden alle Verbindungen, die mit Hydroxid- oder Sulfidionen löslich sind. Zusätzlich bilden Hydroxide Salze, die mit Erdalkalimetallionen (Gruppe II-A) löslich sind: Calcium Ca, Strontium Sr und Barium Ba. Hinweis: Verbindungen aus Hydroxiden und Erdalkalimetallen weisen tatsächlich eine erhebliche Anzahl von Molekülen auf, die miteinander verbunden bleiben, sodass sie manchmal als "schwer löslich" angesehen werden.
CO-haltige Verbindungen3 oder PO4 unlöslich. Überprüfen Sie ein letztes Mal die Carbonat- und Phosphationen, und Sie werden sehen, ob Ihre Verbindung löslich ist.
- Ausnahme: Diese Ionen bilden Verbindungen, die mit Alkalimetallen wie Li, Na, K, Rb und Cs sowie mit dem Ammoniumion NH löslich sind4.
Methode 2 von 2: Berechnen Sie die Löslichkeit aus der Konstanten K.sp
Schlagen Sie die Löslichkeitsproduktkonstante K nachsp. Diese Konstante ist für jede Verbindung unterschiedlich. Sie sollten sie daher in einem Diagramm in einem Lehrbuch oder online nachschlagen. Da diese Werte experimentell bestimmt werden und zwischen den Diagrammen erheblich variieren können, ist es am besten, das Diagramm des Lehrbuchs zu verwenden, falls verfügbar. Sofern nicht anders angegeben, gehen die meisten Diagramme von einer Prüftemperatur von 25 ° C aus.
- Angenommen, Sie lösen Bleijodid mit der Formel PbI auf2, schreiben Sie seine Löslichkeitsproduktkonstante. Wenn Sie sich auf das Diagramm unter bilbo.chm.uri.edu beziehen, verwenden Sie die Konstante 7,1 × 10.
Schreiben Sie eine chemische Gleichung. Das erste bestimmt das ionische Trennmuster dieser Verbindung, wenn sie gelöst ist. Dann schreibe die Gleichung mit K.sp auf der einen Seite und Komponentenionen auf der anderen Seite.
- Zum Beispiel ein PbI-Molekül2 dissoziieren in Ionen Pb, I und I. (Sie müssen nur die Ladung eines Ions kennen oder überprüfen, da alle Verbindungen immer elektrisch neutral sind).
- Schreiben Sie die Gleichung 7,1 × 10 =
- Diese Gleichung ist die Löslichkeitskonstante, die Sie für 2 Ionen in der Löslichkeitstabelle herausfinden können. Da es 2 l-Ionen gibt, muss l- quadratisch sein.
Transformieren Sie Gleichungen, um Variablen zu verwenden. Schreiben Sie die Gleichung mit normalen algebraischen Methoden neu und verwenden Sie dabei die Informationen, die Sie über die Anzahl der Moleküle und Ionen kennen. Setzen Sie x gleich der Masse der aufzulösenden Verbindung und schreiben Sie die Gleichung neu, wobei x die Anzahl jedes Ions darstellt.
- In diesem Beispiel müssen wir die Gleichung 7,1 × 10 = neu schreiben
- Da die Verbindung nur ein Bleiion (Pb) enthält, entspricht die Anzahl der gelösten Moleküle der Anzahl der freien Bleiionen. Daher können wir es auf x setzen.
- Da es für jedes Bleiion zwei Iodionen (I) gibt, setzen wir die Anzahl der Iodatome auf 2x.
- Jetzt wird die Gleichung 7,1 × 10 = (x) (2x)
Berücksichtigen Sie ggf. gebräuchliche Ionen. Überspringen Sie diesen Schritt, wenn Sie die Verbindung in destilliertem Wasser lösen. Wenn eine Verbindung in einer Lösung gelöst wird, die bereits eine oder mehrere Komponentenionen ("gemeinsame Ionen") enthält, nimmt die Löslichkeit der Verbindung signifikant ab. Die Wirkung der allgemeinen Ionen ist bei praktisch unlöslichen Verbindungen am offensichtlichsten, und in diesem Fall können Sie davon ausgehen, dass die meisten Ionen im Gleichgewicht diejenigen sind, die zuvor in Lösung waren. Schreiben Sie die Gleichung neu, um die molare Konzentration (Mol pro Liter oder M) der bereits in der Lösung enthaltenen Ionen zu berechnen, und ersetzen Sie diesen Wert durch die Variable x, die Sie für dieses Ion verwenden.
- Zum Beispiel, wenn die Bleiiodidverbindung in 0,2 M Bleichlorid (PbCl) -Lösung gelöst ist2) werden wir die Gleichung als 7,1 × 10 = (0,2 M + x) (2x) umschreiben. Da 0,2 M eine höhere Konzentration als x ist, könnten wir es auf 7,1 × 10 = (0,2 M) (2x) umschreiben.
Löse die Gleichung. Löse nach x und du wirst die Löslichkeit der Verbindung sehen. Bei der Definition der Löslichkeitskonstante müssen Sie Ihre Antwort in Form der Molzahl der pro Liter Wasser gelösten Verbindungen schreiben. Möglicherweise müssen Sie Ihren Computer verwenden, um die endgültige Antwort zu finden.
- Das folgende Beispiel ist die Löslichkeit in destilliertem Wasser ohne gemeinsame Ionen.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 Mol pro Liter lösen sich auf. Dies ist eine sehr kleine Masse, daher ist diese Verbindung fast unlöslich.
Was du brauchst
- Tabelle der Löslichkeitsproduktkonstanten der Verbindung (K.sp)
Rat
- Wenn Sie experimentelle Daten zur Menge der gelösten Verbindungen haben, können Sie dieselbe Gleichung verwenden, um die Löslichkeitskonstante K zu ermitteln.sp.
Warnung
- Es besteht kein Konsens über die Definitionen dieser Begriffe, aber Chemiker sind sich über die Mehrzahl der Verbindungen einig. Eine Reihe spezieller Verbindungen, in denen sowohl lösliche als auch unlösliche Moleküle signifikante Bestandteile bilden, wobei jede diese Verbindungen unterschiedlich beschreibt.
- Einige alte Lehrbücher sehen NH4OH ist eine lösliche Verbindung. Das ist nicht wahr; Es wurden geringe Mengen an NH-Ionen nachgewiesen4 und OH, aber diese beiden Ionen können sich nicht zu Verbindungen verbinden.